GS1 China 中國物品編碼中心是國家藥監局指定發碼機構,選擇官方發碼,UDI編碼賦碼合規無憂!
--->企業開通GS1 UDI服務平臺,即可實現在一個平臺完成從廠商識別代碼申請、UDI編碼、備案至中國商品信息服務平臺及藥監局數據庫、信息管理、標簽設計、打印噴碼等UDI實施全流程。
目前已實施UDI的醫械企業,90%以上采用GS1碼制,如果你的企業也遇到UDI實施問題,可以看下圖,了解GS1一站式UDI服務。
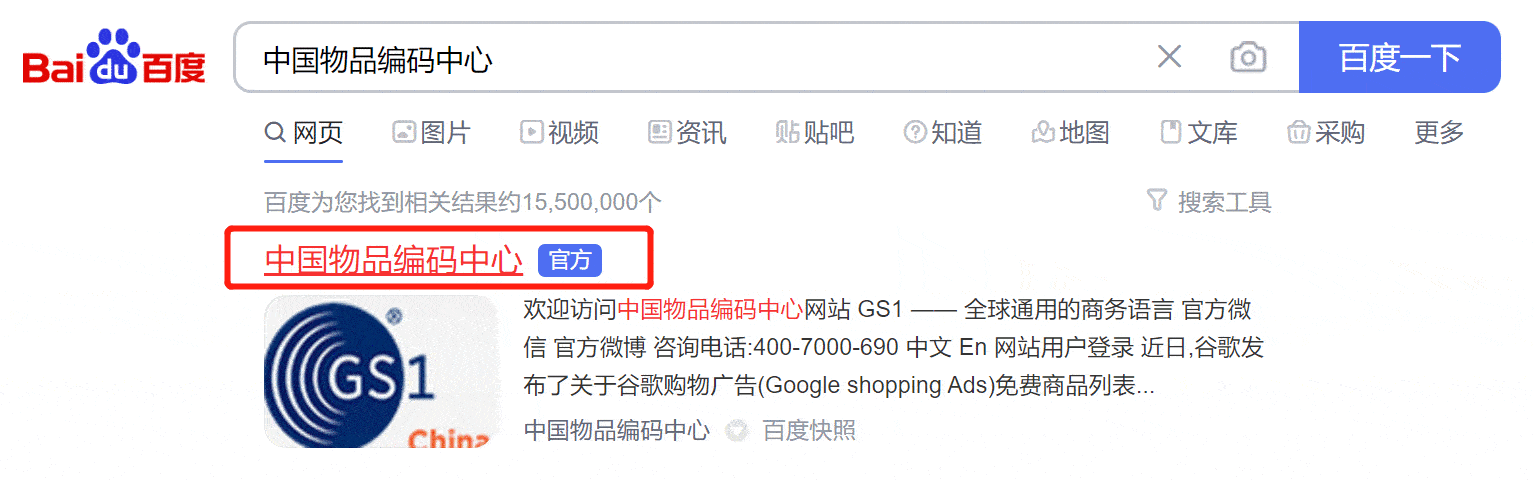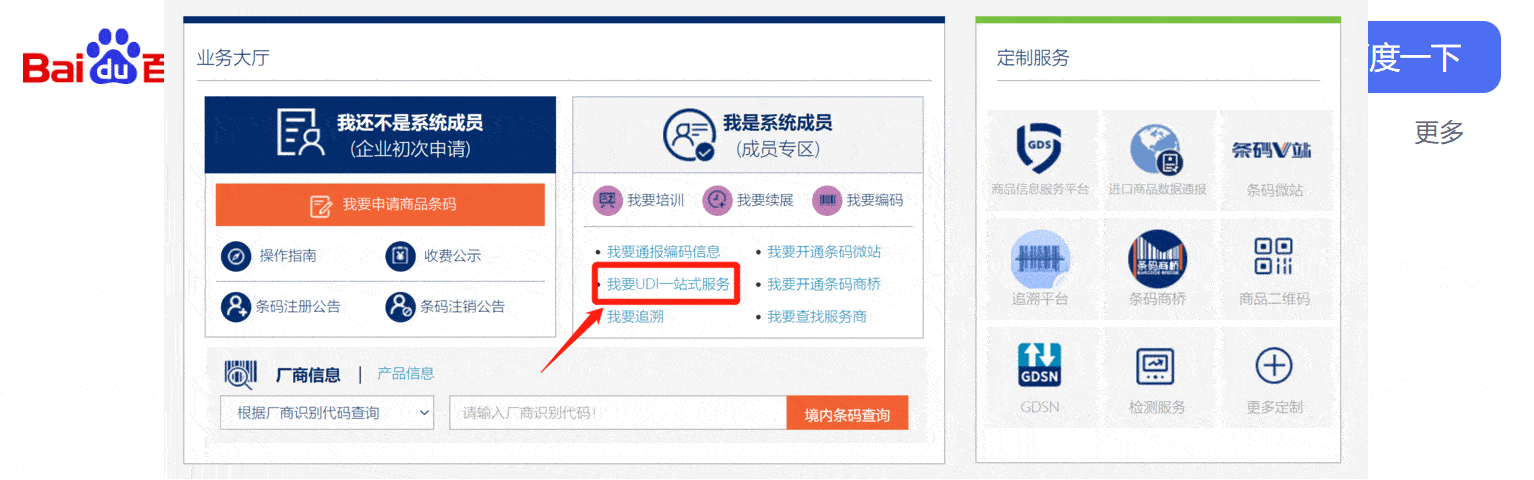
從1月1日起,列入《第一批實施醫療器械唯一標識的產品目錄》的產品首次注冊、延續注冊或者注冊變更時要填產品標識(UDI-DI)。為了讓大家更好的完成產品注冊工作,小編從整理了下面這份內容:
哪些產品應該填UDI-DI?
在12月29日發布的《關于在eRPS系統提交醫療器械唯一標識有關事項的通告》中提到:
對于列入《第一批實施醫療器械唯一標識的產品目錄》中的醫療器械,申請首次注冊、延續注冊或者注冊變更時,申請人或注冊人應當在注冊管理系統中提交其最小銷售單元的產品標識(以下簡稱 UDI-DI)
如何實施?
2019年8月27日發布的《醫療器械唯一標識系統規則》解讀中提到:
注冊人/備案人實施唯一標識的流程為:
第一步:注冊人/備案人按照《規則》和相關標準,結合企業實際情況選擇發碼機構。
第二步:注冊人/備案人按照發碼機構的標準創建產品標識,并確定該產品生產標識的組成。
第三步:《規則》實施之日起(2019年10月1日),申請醫療器械注冊、注冊變更或者辦理備案的,注冊人/備案人應當在注冊/備案管理系統中提交產品標識。
第四步:注冊人/備案人根據發碼機構標準選擇適當的數據載體,對醫療器械最小銷售單元和更高級別的包裝或醫療器械產品上賦予醫療器械唯一標識數據載體。
第五步:注冊人/備案人在產品上市銷售前將產品標識和相關信息上傳至醫療器械唯一標識數據庫。
第六步:產品標識及數據相關信息變化時,注冊人/備案人及時更新醫療器械唯一標識數據庫。
總結:
1、注冊人/備案人按照發碼機構的標準創建UDI-DI
2、在注冊/備案前要在注冊/備案管理系統中提交UDI-DI
3、上市銷售前要將UDI-DI上傳至醫療器械唯一標識數據庫
發碼機構
根據上面的內容可知,要實施UDI-DI必須得有發碼機構的參與。那么發碼機構有哪些呢?要具備哪些條件呢?
2019年8月27日發布的《醫療器械唯一標識系統規則》解讀中提到:
器械唯一標識的發碼機構應當為中國境內的法人機構,具備完善的管理制度和運行體系,確保按照其標準創建的醫療器械唯一標識的唯一性,并符合我國數據安全有關要求。
目前符合上述要求的發碼機構有以下3家:
 資料來源于國家藥監局醫療器械唯一標識數據庫
資料來源于國家藥監局醫療器械唯一標識數據庫
UDI-DI長什么樣?
以中國物品編碼中心GS1碼為例:
 資料來源于國家藥監局醫療器械唯一標識數據庫
資料來源于國家藥監局醫療器械唯一標識數據庫
數據說明:
廠商識別代碼(6948710):廠商識別代碼是由中國物品編碼中心統一向申請廠商分配。廠商識別代碼左起三位由國際物品編碼協會分配給中國物品編碼中心的前綴碼。(通常為:690-695)
商品項目代碼(400**):商品項目代碼由廠商根據有關規定自行分配。
注:廠商在編制商品項目代碼時,最好使用無含義的流水號,即連續號。這樣能夠最大限度利用商品項目代碼的編碼容量。
校驗位(最后一位):用來校驗其他代碼編碼的正誤。它有固定的計算方法。
編碼惟一性原則:同一商品項目應分配相同的標識代碼,不同的商品項目必須分配不同的標識代碼:
1、品種相同,如型號不同,商品項目代碼也應不同。
如上述例子中一次性使用管型吻合器據外形的不同分為VMCSA、VMCSB、VMCSC三種型號,所以他們分別對應不同的項目代碼。
2、品種型號相同,規格不同,商品項目代碼也應不同。
VMCSB型吻合器根據縫合線直徑的不同又各分為17、19、21、23、25、27、29、31、33九種規格。所以他們分別也對應不同的商品項目代碼。
UDI –DI 編碼分配原則
1. 優先遵循監管部門的要求進行編碼分配;
2. 按照發碼機構的標準和規范進行編碼分配;
3. 唯一性原則:對于同一規格型號的產品原則上應當分配一個最小銷售單元產品標識,不同規格型號產品,其產品標識應當不同, 不同產地的同一規格型號產品可分配不同的產品標識;不同包裝規格應分配不同產品標識;
4. 通常情況下,產品的基本特征包括產品名稱、商標、種類、規格、數量、包裝類型等產品特性。醫療器械注冊人/備案人可根據產品特征以及自身的產品管理需求為產品分配唯一的DI;
5. 最小銷售單元包含多于1個的相同使用單元產品,則應當為使用單元分配產品標識;
6. 穩定性原則:DI一旦分配,若產品的基本特征沒有發生變化,就應保持不變;
7. 對于以下情況,需要分配新DI:
1) 監管部門或醫療器械唯一標識數據庫有新的或明確的管理要求時,需分配新DI;
2) 發碼機構的標準和規范有新的要求,需分配新DI;
3) 產品注冊備案時,提報的某項特征信息變化,可能對使用安全、臨床應用產生影響,或會導致對安全及風險管理產生模糊的時候,需分配新DI;
4) 產品注冊備案時,提報的構成產品貿易項目特征的任何要素發生變化,則需分配新DI。
8. 重新使用DI代碼
1) 醫療器械注冊人/備案人必須確保分配給受監管的醫療器械產品的DI代碼永遠不會被重復使用。
2) 例外情況:對于曾從市場撤回,重新上市銷售,并受監管的醫療器械產品,如未出現DI分配規則中提到的特定變更、修改而須申請新的DI代碼,則該產品可以使用原來的DI代碼。具體示例如下,制造商從市場撤回“A產品”第一代某體外診斷試劑。在市場缺席10年后,制造商重新按原有的形式和包裝配置推出“A產品”。在這種情況下,該產品可以使用原來的DI代碼。
9. 包類/組套類產品,DI分配遵循原則:
1) 包類/組套類產品,由包/組/套共同完成一個預期臨床用途,則分配一個DI給包/組套產品(如:麻醉包);
2) 醫療器械注冊人/備案人要考慮對使用單位的安全使用負責(如:整體標識DI、不分拆運輸,避免使用環節組裝搭配差錯);
3) 包類/組套內的產品,如是獨立的醫療器械產品,則可以分配DI;(單獨銷售/使用的情況)
4) 對于包內/組套內的非獨立醫療器械產品(已被認定為醫療器械管理的情況除外),可根據內部控制、質量體系管理的需要使用UDI管理,但數據不需上報CUDID。





